如何判断细菌的运动性?
发布时间:2019-09-04 浏览次数:1541
悬滴法
用悬滴法,通过镜检观察细菌细胞是否具有运动性,可以通过普通显微镜或相差显微镜检查。用普通显微镜时光线不宜太强,要适当减弱。具体操作步骤方法如下。
待测菌株先在肉汤中培养18 h~24 h,也可以从生长了18 h-24 h的营养琼脂斜面上挑取少量菌落用1滴肉汤或生理盐水乳化,注意菌株的浓度不要太大。通过以下方法可以将1滴菌悬液悬浮在凹槽载玻片的盖玻片上。
1. 具体操作步骤
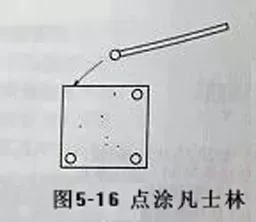
(1)取一洁净的盖玻片,在盖玻片四周点上凡士林(见图5-16)。
(2)用接种环挑取一小环菌株置于操作好的干净盖玻片上,不要让液滴散开(见图5-17)。

(3)将凹槽载玻片盖在盖玻片上,保持菌滴在槽中间,缓慢用力压下载玻片,借助凡士林的黏性使载玻片和盖玻片结合在一起(见图5-18),快速平稳地将玻片反转过来,菌滴应处于悬滴状态(见图5-19)。尽快观察。


(4)观察悬滴玻片时,将镜下聚光镜从其正常位置略微下调,并使光圈几乎处于全关闭状态。这是因为未染色的菌体在太亮的环境下难于被观察到,而且,光造成的热效应会使菌体丧失运动性。
(5)首先用低倍物镜聚焦悬液的边缘,移动载玻片,让悬液在视野的中央。通过观察液滴边缘线外出现的小冷凝水滴能够很容易识别出悬滴的位置。换成高倍物镜(40倍)对液滴边缘重新聚焦。必要时,略微打开光圈。这时细菌应很容易观察到,尤其在液滴的边缘,深度较浅,细菌停留在有限的空间领域。用油镜观察玻片时,因为聚焦时镜头的移动可能造成盖玻片移动,从而造成液滴流动。这会严重影响观察效果,没有经验的人员甚至还会误认为是菌体在运动。
注意:必须正确区分布朗运动(一种液体中悬浮的微小粒子的连续运动,是由于液体周围的分子不对称的撞击造成的)、玻片轻微倾斜造成的一个方向上的漂移和真正的菌体运动。
有时可以根据运动方式的不同来鉴定菌种,如李斯特氏菌是翻跟头式的运动,噬胞菌为滑行运动。要想通过运动方式来鉴定菌种,就必须熟悉不同菌种的运动方式,观察比较已知菌株的运动情况可以不断积累经验。
2. 注意事项
检验时应注意以下几点:
(1)细菌细胞间有明显位移者,才能判定为运动性。由于细菌细胞太小,在悬液中有布朗运动,即每个细胞均在原地颤动,彼此的位置关系却没改变,切不可将这种现象误判为具运动性。由于载玻片与盖玻片之间悬液过多,在使用油浸物镜调焦时,悬液在盖玻片下流动。这时可看到大批细菌细胞都以同一速度向同一方向运动,这也不是真正的运动性。真正的运动性应是细菌细胞彼此的位置关系明显的改变。细菌的运动性因种或菌株而异。有的运动迅速,有的运动缓慢。能运动的菌株也不一定每个细胞都同时运动,常常是大多数细胞不运动,少数细胞明显运动。
(2)有些细胞不以鞭毛运动,而是滑动。镜检时应注意与游动区分开。一般游动速度高,滑动则迟缓。游动只能在悬液中运动,滑动则须附在固体表面进行。
(3)如室温太低,以致载物台温度太低。有的细菌会因温度太低而不能运动,应该设法提高载物台或载玻片的温度,达到试验菌能运动的温度(如在室温较高的试验室镜检,或将载玻片放置保温箱中一会儿再观察)。
(4)镜检好氧菌时,则可能因盖玻片下供氧不足而使试验菌不能表现出运动性,遇到这种情况则应使盖玻片下残留一两个小气泡,镜检气泡四周或盖玻片边缘的细菌运动性。
(5)用油镜观察时,盖玻片的厚度以不超过0. 17 mm为宜。用过厚的盖玻片,调焦有困难。用相差油镜观察时载玻片的厚度以约为1.2 mm为宜。
半固体穿刺
根据有鞭毛的细菌可以在半固体培养基中游动却又不能任意游走的现象,观察细菌生长情况,判定试验菌是否有运动性,可使用试验菌能良好生长的培养基,在其中加入0.3%~0.6%的琼脂(所用琼脂的量可因品牌不同而异),一般半固体培养基应是放倒试管不流动,而在手上轻轻敲打时琼脂即破裂为宜。对一般常见细菌可结合葡萄糖氧化发酵试验观察运动性。
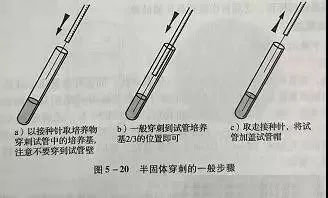
用直针穿刺接种试验菌于半固体培养基内(见图5-20),适温培养。细菌的运动性可用透射光目测。如生长物只生长在穿刺线上,边缘十分清晰,则表示试验菌无运动性;如生长物由穿刺线向四周呈云雾状扩散,其边缘呈云雾状,则表明试验菌株有运动性。对生长快的细菌培养1d后观察。如第一天不能判定可在第2d-3d再观察。如2d-3d时仍不能判定是否有运动性,可延迟5d-6d再观察一次。因为游动力弱的细菌,在半固体培养基中第1d-2d中尚不能从穿刺线游开,故需多培养几天再观察。如试验菌在半固体培养基中产气泡会影响穿刺线上的生长物的扩散情况,不可误将不运动的细菌判为有运动性。如试验菌是好氧细菌,穿刺线上生长物很少,可检查从培养基表面向下渗入的生长物的情况。
文章节选自《食品微生物检测工作指南》转载只为分享知识,如有侵权,请联系删除。





